Il Ferro (Fe) totale dell’organismo nel soggetto adulto maschio è di 3-5g, distribuito in diversi compartimenti:
- il compartimento funzionale: Fe legato all’eme contenuto nell’emoglobina (1.8-2.5g di Fe, neiglobuli rossi e nei precursori eritropietici midollari) e nella mioglobina, in citocromi ed enzimi ad attività ossido- reduttasica (legato o meno all’eme)
- il compartimento di trasporto: Fe circolante legato alla transferrina (3-4mg; il Fe libero è tossico perché favorisce la formazione di radicali liberi dell’ossigeno)
- il compartimento di deposito: Fe contenuto nella Ferritina e nell’emosiderina (aggregati di ferritina) soprattutto all’interno dei macrofagi e degli epatociti (200-1000mg, con notevole varialibità interindividuale).
Il fabbisogno giornaliero di Fe nel maschio adulto e nella donna post-menopausa è di circa 1 mg, raddoppia nella donna in età fertile e aumenta ulteriormente (2.4-4.8mg) durante la gravidanza soprattutto nel terzo trimestre. E’ aumentato anche nel bambino dopo i 6 mesi e ancora di più negli adolescenti (2 mg).
Se il Fe è fondamentale per l’organismo, il sovraccarico risulta dannoso per i tessuti: per questo il metabolismo del Fe è regolato in maniera molto fine, allo scopo di evitarne l’accumulo. Il Fe circolante è veicolato ai tessuti dalla transferrina, una proteina che reca due siti leganti Fe e che si carica del Fe liberato nel plasma dalle cellule della mucosa intestinale (enterociti) e dai macrofagi del sistema reticolo endoteliale che hanno degradato i globuli rossi “senescenti”; le cellule legano la transferrina a livello di specifici recettori e quindi internalizzano il metallo e lo indirizzano ai mitocondri per la sintesi dell’eme o di altre metallo-proteine, mentre l’eccesso viene detossificato in forma di ferritina citosolica. La quantità di Fe che viene giornalmente ricambiata è minima e si aggira intorno a 1-2 mg. In condizioni normali, la perdita di Fe avviene solo attraverso l’ esfoliazione delle mucose del tratto gastrointestinalee genitourinario e della cute, non esiste un meccanismo di eliminazione attiva del Fe. L’assorbimento del Fe contenuto nella dieta occidentale (circa 7mg/1000calorie) è molto limitato. Il Fe- eme presente nella carne, nel pollame, nel pesce è di più facile assorbimento (20-35%) ma il meccanismo alla base non è ancora ben chiarito. Il Fe non-eme contenuto nei cereali, nei legumi e nella frutta secca e nella verdura a foglia verde è assorbito in quantità molto limitata: 5-10%. Nel lume del duodeno e del tratto iniziale del digiuno il Fe inorganico è presente come Fe3+; il pH acido del duodeno favorisce la riduzione enzimatica del Fe3+ a Fe2+ che passa attraverso la membrana dell’enterocita. All’interno dell’enterocita viene utilizzato o immagazzinato o rilasciato in circolo grazie ad una molecola esportatrice, la ferroportina, dopo essere stato riossidato a Fe3+ che si lega alla transferrina per essere veicolato. A livello cellulare il Fe si deposita coniugato ad una proteina, la ferritina, che protegge la cellula dalla potenziale tossicità del Fe. La ferritina endocellulare è composta da subunità H (quella che lega effettivamente il Fe) e L, in rapporto diverso nei vari tessuti.
La biodisponibilità del Fe alimentare dipende dal bilancio tra Fe-eme e non-eme e dalla presenza di sostanze interferenti che possono aumentare o ridurre l’assorbimento. Ascorbato e citrato aumentano l’assorbimento favorendo la riduzione da Fe3+ a Fe2+ e agendo come deboli chelanti che ne favoriscono la solubilità nel duodeno. L’effetto favorente dell’acido ascorbico tuttavia è limitato dalla cottura e dalle preparazioni industriali e dalla co-presenza nei vegetali di fattori inibenti. Anche la carne (di origine bovina e suina, pollame, pesce) sembra in grado di favorire l’assorbimento del Fe inorganico. Fattori inibenti sono invece i fitati (legumi, cereali), i polifenoli (presenti nel te nero, nel caffe’, nel vino, nei cereali e nei legumi, peraltro insieme ai fitati, negli spinaci, nelle melanzane) ed alcune proteine del latte (caseina) e del bianco dell’uovo. Mentre i sopraelencati favorenti o inibenti interferiscono solo sull’assorbimento del Fe non-eme, il Calcio inibisce l’assorbimento di entrambi i tipi di Fe.
Il bilancio del ferro è regolato in modo molto fine da numerosi fattori, e tra questi i due principali sono l’epcidina e la ferroportina. Dal momento che non esiste un meccanismo di escrezione attiva del Fe, l’omeostasi è regolata essenzialmente a livello dell’assorbimento. L’epcidina è una proteina prodotta dall’epatocita che svolge un ruolo di inibitore dell’ingresso del Fe in circolo in quanto si lega al trasportatore ferroportina favorendone la degradazione con conseguente blocco a livello di enterocita e reticolo-endotelio del passaggio di Fe in circolo. In caso di aumentato fabbisogno di Fe il livello diepcidina scende e è favorita l’azione di esportatore della ferroportina con aumentato assorbimento dall’intestino e aumentata dismissione di Fe dai depositi del reticolo endotelio. In caso di eccesso di Fe, il livello di epcidina aumenta con conseguente degradazione della ferroportina e ridotta dismissione di Fe sia dalla mucosa intestinale che dal reticoloendotelio. La produzione di epcidina è regolata da mediatori a partenza dal sistema eritropoietico, dall’ipossia, dall’anemia, dal livello del Fe plasmatico.
La valutazione del bilancio marziale si basa sulla determinazione di:
- sideremia: misura il Fe totale per unità di volume plasmatico
- percentuale di saturazione della transferrina: indica la percentuale di siti leganti che sono effettivamente occupati da Fe su tutte le molecole di transferrina. La % di saturazione può essere calcolata in due modi: sideremia/TIBC cioè il numero totale di siti leganti Fe sulla transferrina, oppure sideremia/transferrina x fattore di correzione 1.42. La transferrinemia misura la quantità di proteina veicolante per unità di volume. La sua sintesi aumenta in condizioni di sideropenia, ma non in condizioni di infiammazione.
- ferritinemia: la ferritina circolante è composta soprattutto da unità L non leganti ferro ed è prodotta da epatociti e macrofagi; il livello in circolo correla strettamente con i depositi soprattutto reticolo endoteliali, se si eccettua la condizione di infiammazione o di necrosi epatica in cui è aumentata indipendentemente dal sovraccarico di Fe per aumentata produzione indotta dalle citochine infiammatorie o per rilascio dalle cellule epatiche necrotiche. Marcata variabilità in questi parametri può essere osservata in rapporto a età, sesso,etnia, ritmo circadiano (ad es. sideremia e saturazione della transferrina sono più alte almattino), presenza di stato infiammatorio, recente assunzione di Fe. Indicatori meno disponibili e non ancora entrati nella pratica clinica: 1) recettore solubile della transferrina (sTfR), che aumenta in condizioni di carenza reale di Fe ed è normale/ridotto in corso di infiammazione; 2) livello di epcidina; 3) rapporto sTfR/logFerritinemia; 4) indici reticolocitari.
La sideropenia è una condizione in cui il Fe totale dell’organismo è ridotto in modo considerevole; se questa condizione si protrae compromette l’apporto di ferro a tutti i tessuti, ma in particolare all’eritropoiesi con insorgenza di anemia sideropenica, la forma più frequente di anemia nel mondo. E’ una condizione generalmente acquisita, anche se recentemente si è sviluppato grande interesse per l’individuazione di varianti genetiche di suscettibilità a svilupparla. In una prima fase si riduce la ferritinemia (<30 μg/L, poi progressivamente <12 μg/L; principale biomarcatore della carenza di Fe), quindi scende la % di saturazione della transferrina (<16%) e successivamente si rileva anemia iporigenerativa microcitica-ipocromica, con volume globulare medio ridotto (MCV<80fl) e contenuto emoglobinico globulare medio ridotto (MCH<27pg).
In corso di malattie infiammatorie croniche l’aumento dell’epcidina provocato dai mediatori infiammatori determina un ridotto assorbimento di Fe e una ridotta dismissione di Fe dal sistema reticolo endoteliale (disturbo del riciclo del Fe) per cui i depositi aumentano mentre la sideremia è ridotta (carenza “funzionale” di Fe). La % di saturazione della transferrina è normale o ridotta, la ferritinemia è >100 μg/L come riflesso della sequestrazione nei macrofagi, l’emoglobina scende moderatamente (anemia delle malattie infiammatorie) con indici eritrocitari MCV e MCH normali o solo lievemente ridotti. Il quadro laboratoristico si complica se coesistono carenza reale di Fe e stato infiammatorio (ad es nelle malattie gastrointestinali infiammatorie con perdita emorragica): la sideremia scende, la % di saturazione della transferrina è ridotta (<20%), la ferritina è <100μg/L e vi è anemia microcitica- ipocromica. Per diagnosticare correttamente la carenza reale di Fe nel contesto di copatologie, specie la patologie infiammatorie tipiche, ma non solo (ad es insufficienza renale, scompenso cardiaco, età avanzata), è importante la combinazione di ridotta % di saturazione della transferrina e di livelli di ferritina < 100 μg/L o anche più alti ( per es nella insufficienza renale si considera un cut-off <300 μg/L). Il riconoscimento della sideropenia assoluta in questi casi rappresenta una difficoltà diagnostica non ancora risolta. Potrebbero essere utili il dosaggio del sTfR, il rapporto sTfR7log Ferritinemia, il livello di epcidina.
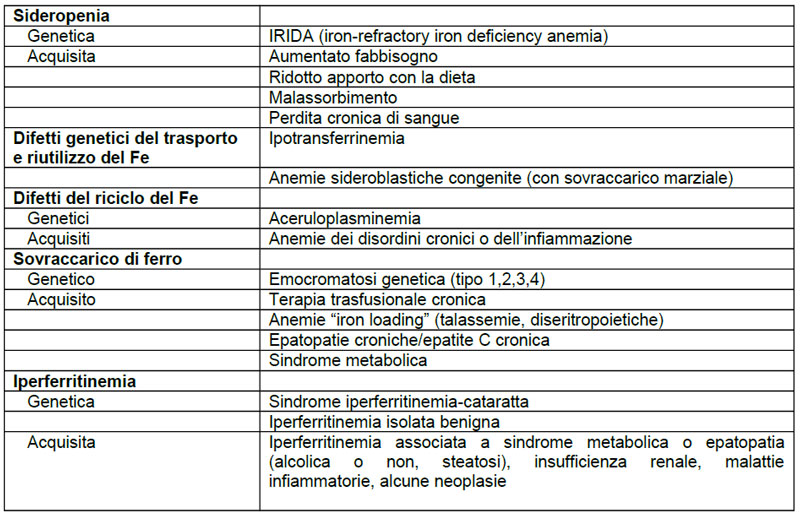
Il sovraccarico di Fe è una condizione in cui il Fe totale dell’organismo supera i livelli considerati normali per età e sesso. Una aumentata % di saturazione della transferrina è prerequisito per l’accumulo marziale a livello parenchimale (soprattutto miocardio, fegato,tessuti endocrini) che comporta danno tessutale. Valori indicativi di sovraccarico sono: sideremia aumentata, % di saturazione della transferrina >45% e ferritina>100 μg/L (donne fertili), >200 μg/L (donne in menopausa), >300 μg/L (maschio adulto), generalmente comunque in presenza di sovraccarico la ferritina è piuttosto elevata. La valutazione del sovraccarico parenchimale richiede l’esecuzione di procedure quali biopsia epatica e risonanza magnetica. Il sovraccarico può essere geneticamente determinato (emocromatosi genetica; mutazioni a carico di geni coinvolti nel metabolismo del Fe, causanti aumentato assorbimento intestinale) o acquisito, generalmente meno marcato rispetto alle forme genetiche..Sono note forme geneticamente determinate di iperferritinemia isolata in assenza di sovraccarico marziale e con % di saturazione della transferrina normale e forme acquisite di iperferritinemia con accumulo di Fe prevalentemente reticol endoteliale in corso di malattie infiammatorie, alcune neoplasie, malattie renali, sindrome dismetabolica e malattie epatiche. In queste condizioni l’iperferritinemia è generalmente di entità inferiore rispetto alle forme di emocromatosi genetica e la % di saturazione della transferrina non è aumentata. Nella tabella è presentata una classificazione dei principali disordini del metabolismo del Fe
- Lynch S et al. Biomarkers of nutrition for development (BOND)-iron review. J Nutr 2018
- Camaschella c. Iron deficiency. Blood 2019
- Ganz T. Anemia of inflammation. N Eng J Med 2019
- Fleming RE, Ponka P. Iron overload in human disease. N Eng J Med 2012
Dott.ssa Ester M. Orlandi
Ematologa